
Druck, Temperatur und Enthalpie
EXPERIMENT 1
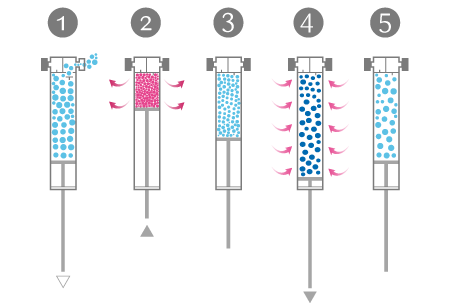
- Luft wird angesaugt
- Luft wird verdichtet und erwärmt sich dabei
- Das Volumen hat sich verringert
- Luft wird unter Kraftaufwand expandiert (kühlt dabei ab)
- Nach Wärmezufuhr hat sich das Volumen wieder ausgedehnt
- den Zusammenhang von Druck und Temperatur.
- die Phasenänderung der Stoffe.
Ein Experiment soll die Physik verdeutlichen:
Wir nehmen eine einfache Kolben-Luftpumpe und verschließen das Auslassventil. Ziehen wir den Kolben heraus, so füllt sich der Hubraum über das Einlassventil mit Luft. Wollen wir nun den Kolben wieder zurückschieben, stoßen wir dabei auf zunehmenden Widerstand, da die Luft nicht mehr entweichen kann.
Mit steigendem Kraftaufwand pressen wir die Luft immer weiter zusammen; die Luft verdichtet sich und erwärmt sich dabei.
Warten wir nun, bis die Luft die entstandene Wärme über das Gehäuse an die Umgebung abgegeben hat, stellen wir fest, dass der Druck ohne Änderung der Kolbenposition geringer wurde.
Jetzt geben wir den Kolben frei und werden feststellen, dass er sich nicht mehr ganz öffnet.
Schließen wir nun auch das Einlassventil und ziehen den Kolben wieder mit Kraftaufwand ganz heraus, so entsteht im Hub ein Unterdruck. Dieser Unterdruck hat eine Abkühlung der Luft zur Folge. Warten wir wiederholt in dieser Position, bis Wärme von außen die kühlere Luft im Hub erwärmen konnte, bleibt der Kolben wieder in seiner Position ohne weiteren Kraftaufwand stehen.
EXPERIMENT 2
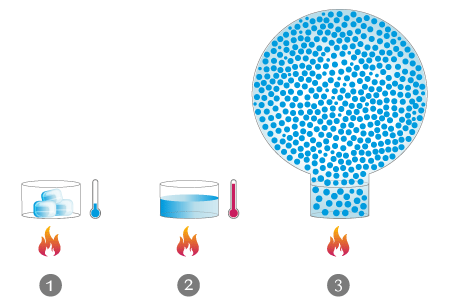
- Eis (0 °C)
- Wasser (0 °C - 100 °C)
- Dampf (100 °C)
In einem zweiten Experiment nehmen wir ein Kilogramm gefrorenes Wasser aus dem Eisschrank, geben es in einen Topf und stellen diesen Topf auf eine Herdplatte.
(Zur Vereinfachung nehmen wir an, dass der Topf mit der Umgebung keine Wärme austauschen kann. Dies hat für die Richtigkeit des Experimentes keine Bedeutung.)
Wir legen den Messfühler eines Thermometers an das Eis und schalten die Herdplatte auf einer kleinen Stufe ein. Am Thermometer lässt sich die langsame, aber stetige Erwärmung des Eises feststellen.
Hat das Eis die Temperatur von 0 °C erreicht, zeigt sich, dass sich die Temperatur plötzlich nicht mehr ändert, obwohl die Herdplatte weiter Energie an den Inhalt des Topfes abgibt.
Dieser Zustand hält so lange an, bis das Eis vollständig geschmolzen ist. Beim nun vorhandenen Wasser können wir wieder einen Anstieg der Temperatur feststellen. Diesmal steigt die Temperatur etwas langsamer.
Wieder erwärmt sich das Wasser gleichmäßig, bis etwa 100 °C erreicht sind und das Wasser zu kochen beginnt.
Das Thermometer bleibt wieder stehen, obwohl weiter die gleiche Menge Energie zugeführt wird. Hier müssen wir zum genaueren Verständnis unser Experiment etwas ausdehnen; und das im Wortsinn:
Wir geben dem entstehenden Dampf Platz. Dazu stülpen wir einen großen leeren (der Einfachheit wegen wieder verlustfreien) Ballon über den Topf, so dass sich der entstehende Dampf darin ungehindert ausdehnen kann, aber nicht verloren geht.
Jetzt wird es bei fortwährender, gleichmäßiger Energiezufuhr deutlich länger dauern, bis alles Wasser in Dampf umgewandelt wurde.
Wir warten aber so lange und können danach wieder eine gleichmäßige Erwärmung des nun in Dampf umgewandelten Wassers feststellen.
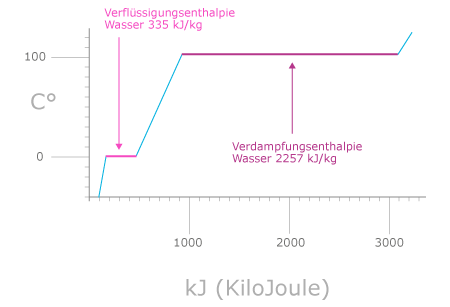
 Erstarrungsenthalpie
Erstarrungsenthalpie
Verdampfungsenthalpie
 Kondensationsenthalpie
Kondensationsenthalpie
Hier unterbrechen wir das Experiment und fassen zusammen:
Damit das Wasser seine Phasen (von fest auf flüssig und von flüssig auf gasförmig) ändern kann, muss ihm Energie zugeführt werden, obwohl sich dabei die Temperatur nicht ändert.
Man spricht hier von Verflüssigungs- bzw. von Verdampfungsenthalpie.
- Eis bei 0°C + Verflüssigungsenthalpie = Wasser bei 0°C
- Wasser bei 0°C - Erstarrungsenthalpie = Eis bei 0°C
- Wasser bei 100°C + Verdampfungsenthalpie = Dampf bei
100°C - Dampf bei 100°C - Kondensationsenthalpie = Wasser bei
100°C

 technische Grundlagen
technische Grundlagen